Фс крушины кора

ФС.2.5.0021.15 Крушины ольховидной кора
Собранная весной до начала цветения кора стволов и ветвей дикорастущего кустарника или небольшого деревца крушины ольховидной (син.: крушина ломкая) — Frangula alnus Mill. (syn.: Rhamnus frangula L.), сем. крушиновых — Rhamnaceae.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Крушины ольховидной кора ФС.2.5.0021.15
Frangulae alni сortex Взамен ГФ XI, вып. 2, ст. 2
(изм. № 2 от 20.08.1997)
Собранная весной до начала цветения кора стволов и ветвей дикорастущего кустарника или небольшого деревца крушины ольховидной (син.: крушина ломкая) — Frangula alnus Mill. (syn.: Rhamnus frangula L.), сем. крушиновых — Rhamnaceae.
ПОДЛИННОСТЬ
Внешние признаки
Цельное сырье. Трубчатые или желобоватые куски коры различной длины, толщиной 0,5 – 2 мм. Наружная поверхность коры более или менее гладкая, темно-коричневая, серо-коричневая, темно-серая или серая, часто с беловатыми поперечно-вытянутыми чечевичками или серыми пятнами, при легком соскабливании наружной части пробки обнаруживается красный слой. Внутренняя поверхность гладкая, желтовато-оранжевого или красновато-коричневого цвета. При рассмотрении под лупой (10%u0D7) или стереомикроскопом (16%u0D7) излом светло-желтый, равномерно мелкощетинистый. Запах слабый. Вкус водного извлечения горьковатый.
Измельченное сырье. Кусочки коры различной формы, проходящие сквозь сито с отверстиями размером 7 мм. Цвет коры с наружной стороны темно-коричневый, серо-коричневый, темно-серый или серый, с внутренней — желтовато-оранжевый или красновато-коричневый. Запах слабый. Вкус водного извлечения – горьковатый.
Порошок. При рассмотрении порошка под лупой (10%u0D7) или стереомикроскопом (16%u0D7) видна смесь частиц коры желтовато-коричневого цвета с коричневыми, темно-коричневыми, серо-коричневыми, темно-серыми, серыми вкраплениями, проходящих сквозь сито с отверстиями размером 2 мм. Запах слабый. Вкус водного извлечения горьковатый.
Микроскопические признаки
Цельное сырье. При рассмотрении поперечного среза должен быть виден темно-красный, широкий пробковый слой в 10 – 20 рядов клеток, прерванный во многих местах чечевичками. Далее лежит пластинчатая колленхима. Наружная кора состоит из овальных клеток и содержит большое количество друз оксалата кальция в некоторых клетках встречаются крахмальные зерна. Механические волокна с мало утолщенными и слабо одревесневшими оболочками. Сердцевинные лучи часто изогнутые, одно-, двух-, реже трехрядные с желтым содержимым. Между сердцевинными лучами расположены группы желтоватых одревесневших лубяных волокон с толстыми стенками, окруженные кристаллоносной обкладкой и образующие концентрические пояса.
Измельченное сырье. При рассмотрении давленного препарата должны быть видны фрагменты темно-красной пробковой ткани, группы желтоватых одревесневших лубяных волокон с кристаллоносной обкладкой, друзы, одиночные кристаллы оксалата кальция.
Порошок. При рассмотрении микропрепарата должны быть видны фрагменты темно-красной пробковой ткани группы желтоватых одревесневших лубяных волокон с толстыми стенками, окруженные кристаллоносной обкладкой друзы и одиночные кристаллы оксалата кальция.
Крушины ольховидной кора
Рисунок – Крушины ольховидной кора.
1 – поперечный срез коры (40%u0D7), 2 – фрагмент поперечного среза коры:
а – пробка, б – колленхима, в – первичная кора (200%u0D7), 3 – фрагмент пробки (200%u0D7), 4 – фрагмент паренхимы с друзами оксалата кальция (200%u0D7),
5 – фрагмент лубяных волокон с кристаллоносной обкладкой:
a – поперечный срез, б – давленый препарат (200%u0D7)
Определение основных групп биологически активных веществ
Приготовление растворов.
Раствор для детектирования. Около 0,5 г калия гидроксида растворяют в 10 мл спирта 50 %. Срок годности раствора не более 3 мес при хранении в прохладном, защищенном от света месте.
Раствор стандартного образца (СО) барбалоина. Около 0,005 г СО барбалоина (алоина) растворяют в 10 мл спирта 96 % и перемешивают. Срок годности раствора не более 3 мес при хранении в хорошо укупоренной упаковке, в прохладном защищенном от света месте.
Около 0,5 г сырья, измельченного до величины частиц, проходящих сквозь сито с отверстиями размером 0,5 мм, помещают в колбу со шлифом вместимостью 100 мл, прибавляют 5 мл спиртаਉ6 % и нагревают с обратным холодильником на водяной бане до кипения. После охлаждения полученное извлечение фильтруют через бумажный фильтр (испытуемый раствор).
На линию старта хроматографической пластинки со слоем силикагеля на алюминиевой подложке размером 10൱0 cм наносят 5 мкл испытуемого раствора и рядом 10 мкл раствора СО барбалоина.
Пластинку с нанесенными пробами сушат при комнатной температуре в течение 5 мин, помещают в камеру (выложенную изнутри фильтровальной бумагой), предварительно насыщенную в течение не менее 60 мин смесью растворителей этилацетат – спирт 96 % – вода (100:17:13), и хроматографируют восходящим способом. Когда фронт растворителей пройдет 80 – 90 % длины пластинки от линии старта, пластинку вынимают из камеры, сушат до удаления следов растворителей, обрабатывают раствором для детектирования, сушат в сушильном шкафу при 100 – 105 °С в течение 3 – 5 мин и просматривают в УФ-свете при длине волны 365 нм.
На хроматограмме раствора СО барбалоина должна обнаруживаться зона адсорбции с флуоресценцией коричнево-желтого, зелено-желтого или желтого цвета.
На хроматограмме испытуемого раствора должны обнаруживаться 2 зоны адсорбции с флуоресценцией оранжево-красного или оранжевого цвета, допускается обнаружение других зон адсорбции не допускается обнаружение зоны от желтого до красно-оранжевого цвета на уровне зоны СО барбалоина
При смачивании внутренней поверхности коры или порошка коры 1 – 2 каплями натрия гидроксида раствора 10 % должно наблюдаться кроваво-красное окрашивание (антраценпроизводные).
ИСПЫТАНИЯ
Влажность
Цельное сырье, измельченное сырье, порошок – не более 15 %.
Зола общая
Цельное сырье, измельченное сырье, порошок – не более 5 %.
Зола, нерастворимая в хлористоводородной кислоте
Цельное сырье, измельченное сырье, порошок – не более 0,6 %.
Измельченность сырья
Цельное сырье: частиц, проходящих сквозь сито с отверстиями размером 3 мм, — не более 5 %. Измельченное сырье – частиц, не проходящих сквозь сито с отверстиями размером 7 мм, – не более 5 % частиц, проходящих сквозь сито с отверстиями размером 0,5 мм, – не более 5 %. Порошок – частиц, не проходящих сквозь сито с отверстиями размером 2 мм, – не более 5 % частиц, проходящих сквозь сито с отверстиями размером 0,18 мм, – не более 5 %.
Посторонние примеси
Участки коры, покрытые кустистыми лишайниками
Цельное сырье – не более 1 %.
Участки коры с остатками древесины
Цельное сырье – не более 1 %.
Куски коры толще 2 мм
Цельное сырье – не более 3 %.
Органическая примесь
Цельное сырье, измельченное сырье – не более 0,5 %.
Минеральная примесь
Цельное сырье, измельченное сырье, порошок – не более 0,5 %.
Тяжелые металлы
В соответствии с требованиями ОФС «Определение содержания тяжелых металлов и мышьяка в лекарственном растительном сырье и лекарственных растительных препаратах».
Радионуклиды
В соответствии с требованиями ОФС «Определение содержания радионуклидов в лекарственном растительном сырье и лекарственных растительных препаратах».
Остаточные количества пестицидов
В соответствии с требованиями ОФС «Определение содержания остаточных пестицидов в лекарственном растительном сырье и лекарственных растительных препаратах».
Микробиологическая чистота
В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение
Цельное сырье, измельченное сырье, порошок: сумма антрагликозидов в пересчете на истизин или глюкофрангулин А – не менее 4,5 %.
Сумма антрагликозидов в пересчете на глюкофрангулин А
Приготовление растворов.
Натрия карбоната раствор 5 %. 5,0 г натрия карбоната безводного растворяют в воде, доводят объем раствора водой до 100 мл и перемешивают. Срок годности раствора не более 30 сут при хранении в прохладном, защищенном от света месте.
Железа(III) хлорида раствор (плотность 1,07 – 1,08). 20,0 г железа(III) хлорида растворяют в 100 мл воды, доводят водой до величины плотности 1,07 – 1,08 и перемешивают. Срок годности раствора не более 3 мес при хранении в хорошо укупоренной упаковке, в прохладном защищенном от света месте.
Магния ацетата раствор спиртовой 0,5 %. 0,5 г магния ацетата растворяют в спирте 96 %, доводят объем раствора тем же спиртом до 100 мл и перемешивают. Срок годности раствора не более 2 мес при хранении в прохладном, защищенном от света месте.
Для анализа используется эфир диэтиловый квалификации «химически чистый».
Аналитическую пробу сырья измельчают до величины частиц, проходящих сквозь сито с отверстиями размером 0,5 мм. Около 0,25 г (точная навеска) сырья помещают в колбу со шлифом вместимостью 100 мл, прибавляют 25 мл спирта 80 %, взвешивают с погрешностью %u0B1,01 г, присоединяют к обратному холодильнику и нагревают на кипящей водяной бане в течение 15 мин. После охлаждения до комнатной температуры колбу вновь взвешивают и доводят до первоначальной массы спиртом 80 %. Содержимое колбы фильтруют через бумажный складчатый фильтр.
5,0 мл фильтрата помещают в делительную воронку вместимостью 250 мл, прибавляют 50 мл воды и 0,10 мл хлористоводородной кислоты концентрированной и осторожно взбалтывают в течение 2 – 3 мин с 20 мл петролейного эфира (х.ч.). После полного расслоения фаз нижний водный слой переносят в стакан вместимостью 100 мл, верхний эфирный слой переносят в колбу вместимостью 250 мл. Далее водный слой из стакана переносят в ту же делительную воронку и аналогичным образом обрабатывают еще 4 раза петролейным эфиром (порциями по 20 мл). Водный слой переносят в мерную колбу вместимостью 100 мл. Объединенные петролейные извлечения переносят обратно в делительную воронку и промывают водой 2 раза (порциями по 15 мл), водный слой помещают в ту же мерную колбу вместимостью 100 мл, оставляя темные хлопья в эфирном слое. В мерную колбу с объединенными водными извлечениями прибавляют 5 мл натрия карбоната раствора 5 % и доводят объем раствора водой до метки (раствор А).
50,0 мл раствора А пипеткой переносят в колбу со шлифом вместимостью 250 мл, прибавляют 20 мл железа(III) хлорида раствора (плотность 1,07 – 1,08), присоединяют к обратному холодильнику и нагревают на кипящей водяной бане при периодическом перемешивании в течение 20 мин, погружая колбу в воду бани выше уровня раствора в колбе. Затем в колбу прибавляют 2 мл хлористоводородной кислоты концентрированной и продолжают нагревать в течение 20 мин, часто встряхивая, до растворения осадка.
Колбу охлаждают, и ее содержимое переносят в делительную воронку вместимостью 500 мл, колбу ополаскивают 30 мл эфира, присоединяют к основному раствору в делительной воронке и осторожно взбалтывают в течение 2 – 3 мин. После полного расслоения фаз нижний водный слой переносят в ту же колбу вместимостью 250 мл, а эфирный слой собирают в колбу вместимостью 100 мл. Извлечение повторяют еще 2 раза аналогичным образом. Объединенные эфирные извлечения переносят обратно в делительную воронку и промывают 2 раза водой (по 15 мл), водный слой отбрасывают. Эфирные извлечения фильтруют через воронку с бумажным фильтром, содержащим 3,0 г натрия сульфата безводного, в мерную колбу вместимостью 100 мл. Воронку с натрия сульфатом безводным промывают эфиром и доводят объем раствора тем же растворителем до метки и перемешивают (раствор Б).
Через 60 мин 20,0 мл раствора Б пипеткой переносят в низкий стеклянный стакан или бюкс вместимостью 100 мл и сушат досуха в вытяжном шкафу. Сухой остаток полностью растворяют в
10 мл магния ацетата спиртового раствора 0,5 % (раствор В).
Оптическую плотность раствора В измеряют на спектрофотометре при длине волны 515 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения спирт 96 %.
Содержание суммы антрагликозидов в пересчете на глюкофрангулин А в абсолютно сухом сырье в процентах (Х) вычисляют по формуле:

где А — оптическая плотность раствора В
![]() – удельный показатель поглощения глюкофрангулина А при длине волны 515 нм, равный 204
– удельный показатель поглощения глюкофрангулина А при длине волны 515 нм, равный 204
а — навеска сырья, г
W – влажность сырья, %.
Сумма антрагликозидов в пересчете на истизин
Приготовление растворов.
Щелочно-аммиачный раствор. 50 г натрия гидроксида растворяют при перемешивании в 870 мл воды. После охлаждения раствора прибавляют 80 мл аммиака раствора концентрированного 25 % и перемешивают. Срок годности раствора 1 сут.
Аналитическую пробу сырья измельчают до размера частиц, проходящих сквозь сито с отверстиями размером 1 мм. Около 0,05 г (точная навеска) измельченного сырья помещают в колбу со шлифом вместимостью 100 мл, прибавляют 7,5 мл уксусной кислоты ледяной и нагревают смесь на кипящей водяной бане с обратным холодильником в течение 15 мин. После охлаждения в колбу прибавляют через холодильник 30 мл эфира и кипятят на водяной бане в течение 15 мин. Затем извлечение охлаждают, фильтруют через вату в делительную воронку вместимостью 300 мл и вату промывают 20 мл эфира. Вату переносят обратно в колбу, прибавляют 30 мл эфира и кипятят в течение 10 мин. Охлажденное эфирное извлечение фильтруют через вату в ту же делительную воронку. Колбу дважды ополаскивают эфиром (по 10 мл) и фильтруют через ту же вату. К объединенным извлечениям осторожно, по стенкам прибавляют 100 мл щелочно-аммиачного раствора и осторожно взбалтывают в течение 5 – 7 мин, охлаждая воронку под струей холодной воды. После полного расслоения прозрачный красный нижний слой, не фильтруя, сливают в мерную колбу вместимостью 250 мл, а эфирный слой обрабатывают порциями по 20 мл щелочно-аммиачного раствора до прекращения окрашивания жидкости, сливают окрашенные растворы в ту же мерную колбу и доводят объем раствора в колбе щелочно-аммиачным раствором до метки.
25,0 мл полученного раствора помещают в колбу и нагревают в течение 15 мин на кипящей водяной бане с обратным холодильником. После охлаждения измеряют оптическую плотность раствора на фотоэлектроколориметре при длине волны около 540 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения щелочно-аммиачный раствор. При получении слишком интенсивной окраски раствор перед колориметрированием разбавляют щелочно-аммиачным раствором.
Концентрацию антрагликозидов в пересчете на истизин в растворе определяют по калибровочному графику.
Содержание антрагликозидов в пересчете на истизин в абсолютно сухом сырье в процентах (X) вычисляют по формуле:

где С — концентрация антрагликозидов в пересчете на истизин в 1 мл раствора, найденное по калибровочному графику, г
a — навеска сырья, г
W — влажность сырья, %.
Построение калибровочного графика. 50,0 г кобальта хлорида
(CoCl2 · 6H2O), высушенного до постоянной массы, помещают в мерную колбу вместимостью 500 мл, растворяют в 250 мл воды, прибавляют 1 мл хлористоводородной кислоты, доводят объем раствора водой до метки и перемешивают. Из этого раствора готовят серию разбавленных растворов (№ 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12), содержащих кобальта хлорида соответственно 0,0025 0,0050 0,0075 0,0100 0,0125 0,0150 0,0175 0,0200 0,0225 0,0250 0,0275 0,0300 г в 1 мл, и измеряют их оптическую плотность на фотоэлектроколориметре при длине волны около 530 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения воду. Для построения калибровочного графика по оси абсцисс откладывают концентрацию растворов, а по оси ординат — их оптическую плотность. При этом концентрации растворов кобальта хлорида выражают в соответствующих концентрациях антраценопроизводных (в пересчете на истизин), пользуясь таблицей.
Таблица – Соотношения содержания антраценопроизводных в пересчете на истизин содержащего кобальта хлорида (CoCl2 · 6H2O), г/мл в растворе
№ п/п
Содержание
кобальта хлорида
(CoCl2 · 6H2O), г/мл
Содержание
антраценопроизводных в пересчете на истизин, г/мл
1
2
3
4
5
6
7
8
9
10
11
12
0,0025
0,0050
0,0075
0,0100
0,0125
0,0150
0,0175
0,0200
0,0225
0,0250
0,0275
0,0300
0,0000009
0,0000018
0,0000027
0,0000036
0,0000045
0,0000054
0,0000063
0,0000072
0,0000081
0,0000090
0,0000099
0,0000108
Примечание. Определение суммы антрагликозидов в пересчете на истизин проводят в сырье, предназначенном для получения экстракта сухого определение суммы антрагликозидов в пересчете на глюкофрангулин А проводят в сырье, предназначенном для производства лекарственных растительных препаратов (пачки, фильтр-пакеты).
Упаковка, маркировка и транспортирование
В соответствии с требованиями ОФС «Упаковка, маркировка и транспортирование лекарственного растительного сырья и лекарственных растительных препаратов».
Хранение
В соответствии с требованиями ОФС «Хранение лекарственного растительного сырья и лекарственных растительных препаратов».
Скачать в PDF ФС.2.5.0021.15 Крушины ольховидной кора
ISSN 1996-3955 ИФ РИНЦ = 0,618
1 Правдивцева О.Е. 1 Куркин В.А. 1 Авдеева Е.В. 1 Куркина А.В. 1 Шмыгарева А.А. 2 Агапов А.И. 1 Кулагин О.Л. 1 1 ФГБОУ ВО «Самарский государственный медицинский университет» Министерства здравоохранения РФ2 ФФГБОУ ВО «Оренбургский государственный медицинский университет» Министерства здравоохранения РФ
В ходе настоящих исследований выделены и охарактеризованы доминирующие компоненты коры крушины ломкой – Frangula alnus Mill. (франгулин А, франгулин В), плодов жостера слабительного – Rhamnus cathartica L. (1–О-β-D-глюкозида эмодина, 3–О-рутинозид рамнетина), корней щавеля конского – Rumex confertus Willd. (8–О-β-D-глюкозид эмодина), листьев кассии, или сенны александрийской – Cassia acutifolia Del. (1,7–дигидрокси-3–карбоксиантрахинон, реин, кемпферол-3–O-гентиобиозид), травы зверобоя продырявленного – Hypericum perforatum L. (гиперицин, гиперозид, бисапигенин, рутин, кверцетин) и травы зверобоя пятнистого – Hypericum maculatum Grantz. (гиперицин, гиперозид, рутин, кверцетин). на основе результатов химических исследований обоснованы новые подходы к стандартизации антраценсодержащих видов лекарственного растительного сырья, включенных в Государственную фармакопею Российской Федерации XIII издания. Доказано, что в сырье растений (виды зверобоя, виды кассии, жостер слабительный), содержащих одновременно антраценпроизводные и флавоноиды, стандартизацию целесообразно осуществлять с учетом наличия обеих групп биологически активных соединений.
Hypericum maculatum Grantz.лекарственное растительное сырье
1. Государственная Фармакопея СССР. – Одиннадцатое издание. – Вып. 2. – М.: Медицина, 1990. – 400 с.r2. Государственная Фармакопея Российской Федерации. XIII издание. Т.3. – М., 2015. – 1294 с.r3. Куркин В.А., Правдивцева О.Е. Зверобой: итоги и перспективы создания лекарственных средств: Монография. – Самара: ГОУ ВПО «СамГМУ» ООО «Офорт», 2008. – 127 с.r4. Куркин В.А., Шмыгарева А.А., Саньков А.Н. Антраценпроизводные фармакопейных растений: Монография. – Самара: ООО «Офорт», ГБОУ ВПО СамГМУ Минздрава России, 2016. — 210 с.r5. Куркин В.А. Фармакогнозия: Учебник для студентов фармацевтических вузов (факультетов.). 2-е изд., перераб. и доп. Самара: ООО «Офорт» ГОУ ВПО «СамГМУ Росздрава», 2007. – 1239 с.r6. Demirezer L.O., Karahan1 N., Ucakturk E., Kuruuzum-Uz A., Guvenalp Z., Kazaz C. HPLC Fingerprinting of Sennosides in Laxative Drugs with Isolation of Standard Substances from Some Senna Leaves // Rec. Nat. Prod. 2011. – Vol. 5, No. 4. – P. 261–270.r7. European Pharmacopoeia. – 8th Ed.. – Vol. 1. – Strasbourg: Council of Europe, 2014. – 1456 p.r8. Sakulpanich A., Gritsanapan W. Determination of Anthraquinone Glycoside Content in Cassia fistula Leaf Extracts for Alternative Source of Laxative Drug // International Journal of Biomedical and Pharmaceutical Sciences. – 2009. – Vol. 3, No. 1. – P. 42–45.
В медицинской практике широко применяются лекарственные препараты на основе лекарственного растительного сырья (ЛРС), содержащего антраценпроизводные [4, 5], а именно: листья и плоды кассии остролистной (Сassia acutifolia Del.), или сенны александрийской (Senna alexandrina Mill.), листья и плоды кассии узколистной (Cassia angustifolia Vahl.), трава зверобоя продырявленного (Hypericum perforatum L.) и трава зверобоя пятнистого (Hypericum maculatum Grantz.).
Одной из актуальных проблем в фармации является совершенствование методов анализа ЛРС и фитопрепаратов, причем одной из противоречивых проблем с точки зрения фармакопейного анализа является стандартизация ЛРС, содержащего антраценпроизводные. Внедрение методов тонкослойной хроматографии (ТСХ) и высокоэффективной жидкостной хроматографии (ВЭЖХ) открыло новые возможности для целей стандартизации ЛРС и фитопрепаратов, что нашло отражение в вышедшей в свет Государственной фармакопее Российской Федерации XIII издания [2]. в Государственную фармакопею Российской Федерации XIII издания включены виды сырья вышеперечисленных лекарственных растений: ФС.2.5.0038.15 «Сенны листья», ФС 2.5.0021.15 «Крушины ломкой кора», ФС 2.5.0014.15 «Жостера слабительного плоды», 2.5.0052.15 «Щавеля конского корни» и 2.5.0015.15 «Зверобоя трава», однако по-прежнему актуальной остается проблема совершенствования методов стандартизация ЛРС и фитопрепаратов,
Цель настоящих исследований – научное обоснование методологических подходов к стандартизации лекарственного растительного сырья, содержащих антраценпроизводные.
Материалы и методы исследования
В качестве объектов исследования служили кора крушины ломкой (Frangula alnus Mill.), плоды жостера слабительного (Rhamnus cathartica L.), корни щавеля конского (Rumex confertus Willd.), листья сенны александрийской (Cassia acutifolia Del.), трава зверобоя продырявленного (Hypericum perforatum L.) и трава зверобоя пятнистого (Hypericum maculatum Grantz.), а также антраценпроизводные и флавоноиды, выделенные из вышеперечисленного ЛРС. Выделение индивидуальных веществ из ЛРС осуществляли с использованием колоночной хроматографии. Контроль за разделением веществ осуществляли с помощью ТСХ-анализа на пластинках «Сорбфил ПТСХ-АФ-А-УФ». Cпектры ЯМР 1Н и ЯМР 13С получали на приборе ruker AM 300», масс-спектры снимали на масс-спектрометре «Kratos MS-30», регистрацию УФ-спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena).
Результаты исследования и их обсуждение
В результате исследования компонентного состава коры крушины ломкой, плодов жостера слабительного, корней щавеля конского, листьев сенны александрийской, травы зверобоя продырявленного и травы зверобоя пятнистого выделены в индивидуальном виде доминирующие вещества, представленные антраценпроизводными (1–8) (рис. 1) и флавоноидами (9–14) (рис. 2).
В ходе научного обоснования подходов к стандартизации ЛРС, содержащего антраценпроизводные, нами принималось во внимание то обстоятельство, что наряду с антраценпроизводными в сырье содержатся и другие БАС, частности, флавоноиды и дубильные вещества [3], которые представляют интерес с точки зрения диагностики. Так, в листьях сенны александрийской и сенны узколистной флавоноид кемпферол-3–O-гентиобиозид (13) является доминирующим фенольным компонентом и во многом определяет УФ-спектр водно-спиртовых извлечений сырья данных растений. в плодах жостера слабительного доминирующим фенольным компонентом является 3–О-рутинозид рамнетина (14) (флавоноид). в корнях щавеля конского второй группой БАС являются дубильные вещества. Трава зверобоя продырявленного и трава зверобоя пятнистого с точки зрения химической классификации относятся к флавоноидам, однако очень важным является учет наличия в сырье данных растений антраценпроизводных, которые обусловливают антидепрессантное действие лекарственных препаратов на основе травы зверобоя и рассматриваются за рубежом как их критерии качества.
Следовательно, успешное решение проблемы стандартизации возможно лишь на основе учета совокупной значимости содержащихся в сырье различных групп БАС.
Качество сырья «Зверобоя трава» регламентирует ГФ РФ XIII издания (ФС.2.5.0015.15). Раздел «Подлинность» наряду с внешними и микроскопическими признаками включает определение основных групп биологически активных веществ с использованием ТСХ и стандартного образца рутина (10), являющегося 3–О-рутинозидом кверцетина (11). на наш взгляд, в данном методе целесообразно было бы использование ГСО гиперозида (9) – второго по значимости (после рутина) флавоноида для зверобоя продырявленного и доминирующего флавоноида в траве зверобоя пятнистого. Кроме того, использование второго стандарта в методиках – довольно часто применяемый методический подход, который соответствует современным тенденциям фармацевтического анализа.
Количественное определение суммы флавоноидов осуществляют методом дифференциальной спектрофотометрии при аналитической длине волны 415 нм с использованием ГСО рутина. на наш взгляд, было бы целесообразным определение в траве зверобоя не только суммы флавоноидов, но и суммы антраценпроизводных, принимая во внимание то обстоятельство, что данная группа веществ, во-первых, отвечает за антидепрессантный эффект, а, во-вторых, тот факт, что в Европейской фармакопее стандартизация данного сырья осуществляется по содержанию антраценпроизводных (в пересчете на гиперицин). Сравнительное исследование химического состава сырья фармакопейных видов зверобоя показало (метод ВЭЖХ), что в траве зверобоя продырявленного среди флавоноидов преобладает рутин [5], тогда как в траве зверобоя пятнистого доминирует гиперозид (9). Кроме того, в последнем виде не обнаружен 3,811–бисапигенин (12), содержащийся в траве зверобоя продырявленного и обладающий, по нашим данным, антидепрессантной активностью. Результаты данных исследований свидетельствуют о целесообразности стандартизации сырья и препаратов зверобоя не только по содержанию флавоноидов, но и антраценпроизводных.
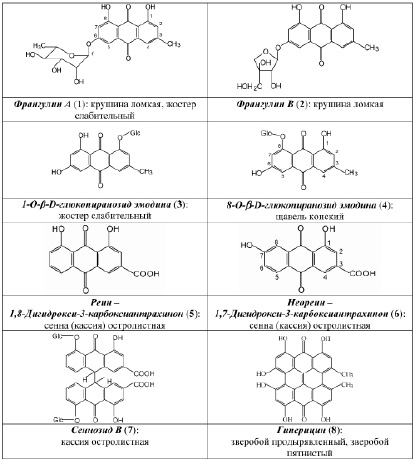
Рис. 1. Антраценпроизводные фармакопейных растений
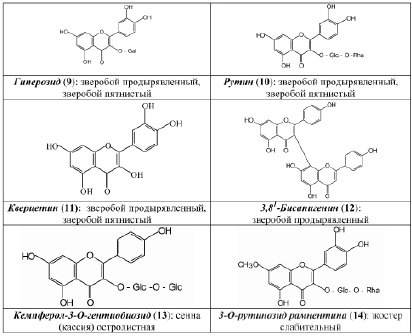
Рис. 2. Флавоноиды антраценсодержащих фармакопейных растений
Одной из нерешенных проблем с точки зрения фармакопейного анализа является стандартизация сырья видов кассии, или сенны. Целесообразность внедрения новых современных методов анализа связана с тем, что в существующих подходах к анализу не в полной мере используется все разнообразие химического состава сырья кассии [1, 2, 6–8]. на наш взгляд, актуальным является учет значимости флавоноидов, в частности, кемпферол-3–О-гентиобиозида (13), как по содержанию, так и по возможному вкладу в фармакологическое действие препаратов на основе кассии.
С использованием ТСХ обнаружено, что именно кемпферол-3–О-гентиобиозид является доминирующим компонентом листьев сенны. на наш взгляд, обнаружение методом ТСХ данного соединения, диагностически значимого для листьев сенны, является перспективным подходом в плане идентификации сырья данного растения. Это тем более важно, что в силу невысокого содержания сеннозида а и в в листьях кассии [6, 8] определение данных антрагликозидов методом ТСХ весьма проблематично. по нашим данным, доминирующим соединением листьев кассии является близкий к реину (5) по хроматографической подвижности и физико-химическим характеристикам 1,7–дигидрокси-3–карбоксиантрахинон (6), являющийся новым природным соединением.
Кроме того, методика количественного определения суммы антраценпроизводных, включенная в ФС.2.5.0038.15 «Сенны листья», на наш взгляд, имеет ряд недостатков: является многостадийной и небезопасной, включающей такие стадии, как кислотный гидролиз, многократную экстракцию сырья, обработку диэтиловым эфиром – легкокипящим огнеопасным растворителем. Методики количественного определения антраценпроизводных, включенные в зарубежные фармакопеи, с точки зрения пробоподготовки сопоставимы с ГФ СССР XI издания [1] и ГФ РФ XIII издания (ФС.2.5.0038.15 «Сенны листья») и отличаются только значением используемой аналитической длиной волны (515 нм вместо 523 нм), а также подходом [7], предусматривающим расчет содержания на сеннозид в (7).
В соответствии с Европейской фармакопеей для расчета содержания суммы антраценпроизводных целесообразно использовать теоретическое значение удельного показателя поглощения (240) стандартного образца сеннозида в [7]. Видимо, поэтому наблюдается расхождения в регламентируемых числовых показателях: содержание сырье суммы агликонов антраценового ряда в пересчете на хризофановую кислоту не менее 1,35 % и содержание суммы антрагликозидов не менее 2,5 % в пересчете на сеннозид B [7].
Аналогичные проблемы нами решены и при разработке методик качественного и количественного анализа плодов жостера слабительного, коры крушины ломкой и корней щавеля конского [4], в случае которых обосновано использование стандартных образцов франгулина а (1) и 8–О-b-D-глюкопиранозида эмодина (4). Так, в случае коры крушины ломкой ГФ РФ XIII издания раздел «Подлинность» включает определение основных групп биологически активных веществ с использованием ТСХ и стандартного образца барбалоина. Методический подход, предусматривающий определение подлинности по отсутствию барбалоина, который в отличие от франгулина а (1) и франшулина в (2) не содержится в коре крушины, представляется ошибочным решением. Что касается раздела «Количественное определение», то представляется нелогичным включение в ГФ РФ XIII издания (двух методик – из ГФ СССР XI издания (в пересчете на истизин) и Европейской фармакопеи (в пересчете на глюкофрангулин А). Видимо, поэтому числовой показатель «сумма антрагликозидов» в отечественной и европейской фармакопеях отличаются значительно – 4,5 % и 7 % соответственно. Нами на примере данного сырья показано, что определение содержания антраценпроизводных целесообразно определять без сочетания таких стадий или процессов, как кислотный гидролиз (ледяная уксусная кислота) и экстракция (диэтиловый эфир). при этом определение содержания суммы антраценпроизводных осуществляется методом спектрофотометрии при длине волны 524 нм в пересчете на франгулин А, являющийся доминирующим антрагликозидом коры крушины.
Выводы
Таким образом, результаты проведенных исследований позволили научно обосновать новые подходы к стандартизации фармакопейных видов ЛРС, содержащих антраценпроизводные. Доказано, что в сырье растений (виды зверобоя, виды кассии, жостер слабительный), содержащих одновременно антраценпроизводные и флавоноиды, стандартизацию целесообразно осуществлять с учетом обеих групп действующих веществ.
Библиографическая ссылка
Правдивцева О.Е., Куркин В.А., Авдеева Е.В., Куркина А.В., Шмыгарева А.А., Агапов А.И., Кулагин О.Л. АКТУАЛЬНЫЕ ВОПРОСЫ СТАНДАРТИЗАЦИИ АНТРАЦЕНСОДЕРЖАЩИХ ВИДОВ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ, ВКЛЮЧЕННЫХ В ГОСУДАРСТВЕННУЮ ФАРМАКОПЕЮ РОССИЙСКОЙ ФЕДЕРАЦИИ // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 12-2. – С. 272-276
URL: http://applied-research.ru/ru/article/view?id=10822 (дата обращения: 25.07.2018).
Крушина ольховидная (Frángula álnus Mill.)
1. Государственная Фармакопея СССР. Одиннадцатое издание. Выпуск 1 (1987), выпуск 2 (1990).
2. Государственный Реестр лекарственных средств. Москва 2004.
3. Лекарственные растения государственной фармакопеи. Фармакогнозия. (Под ред. И.А. Самылиной, В.А. Северцева). – М., «АМНИ», 1999.
4. Ильина Т.А. Лекарственные растения России (Иллюстрированная энциклопедия). – М., «ЭКСМО» 2006.
5. Замятина Н.Г. Лекарственные растения. Энциклопедия природы России. М. 1998.
6. Машковский М.Д. «Лекарственные средства». В 2 т. — М., ООО «Издательство Новая Волна», 2000.
7. «Фитотерапия с основами клинической фармакологии» под ред. В.Г. Кукеса. – М.:Медицина, 1999.
8. П.С. Чиков. «Лекарственные растения» М.: Медицина, 2002.
9. Соколов С.Я., Замотаев И.П. Справочник по лекарственным растениям (фитотерапия). – М.: VITA, 1993.
10. Маннфрид Палов. «Энциклопедия лекарственных растений». Под ред. канд. биол. наук И.А. Губанова. Москва, «Мир», 1998.
11. Турова А.Д. «Лекарственные растения СССР и их применение». Москва. «Медицина». 1974.
12. Лесиовская Е.Е., Пастушенков Л.В. «Фармакотерапия с основами фитотерапии.» Учебное пособие. – М.: ГЭОТАР-МЕД, 2003.
13. Лекарственные растения: Справочное пособие. / Н.И. Гринкевич, И.А. Баландина, В.А. Ермакова и др. Под ред. Н.И. Гринкевич – М.: Высшая школа, 1991. – 398 с.
14. Носов А.М. Лекарственные растения в официнальной и народной медицины. М.: Изд-во Эксмо, 2005. – 800 с.
15. Растения для нас. Справочное пособие / Под ред. Г.П. Яковлева, К.Ф. Блиновой. – Изд-во «Учебная книга», 1996. – 654 с.
16. Растительные ресурсы России: Дикорастущие цветковые растения, их компонентный состав и биологическая активность. Под редакцией А.Л. Буданцева. Т.5. М.: Товарищество научных изданий КМК, 2013. – 312 с.
17. Лекарственное растительное сырье. Фармакогнозия: Учеб. пособие / Под ред. Г.П. Яковлева и К.Ф. Блиновой. – СПб.: СпецЛит, 2004. – 765 с.
18. Цицин Н.В. Атлас лекарственных растений СССР. М. 1962.
19. Шанцер И.А. Растения средней полосы Европейской России. Полевой атлас. М. 2007.








